メディカルアドバイザリーボードの進め方の例
メディカルアドバイザリーボードの進め方のイメージを図1に示します。
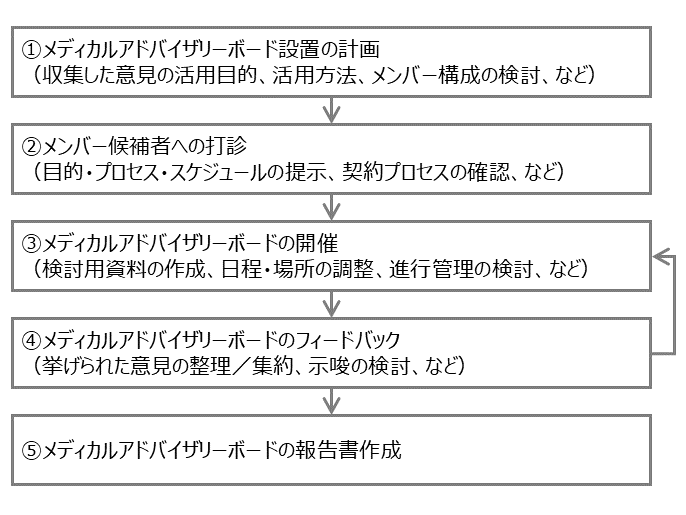
最初に設置計画を立案します。設置の目的・ゴール・結果の活用方法を明確にした上で、どのようなメンバー構成が適当かを検討します。複数の部署で交流があるメンバー候補については、コミュニケーションに齟齬や矛盾が生じないよう事前の調整や認識合わせが求められます(図1①)。次に、作成した計画のコンセプトやスケジュール、開催頻度などをもとに、メンバー候補に参加を打診します。所属機関によって契約の形態や兼業あるいは講師・委員派遣依頼などの書類が必要になることから、書類整備の期間を考慮して十分な準備期間を想定することが望ましいでしょう(図1②)。メンバーが決定し契約が完了した後に、実際の開催に向けて調整を行います。日程・場所の調整に加え、効率的に意見を得られるような提示のための検討用資料の準備や、どのような形で進行を行うかについて検討、あるいはメンバーと協議します(図1③)。メディカルアドバイザリーボードで得られた意見は議事録として整理、集約した上で、得られた示唆について整理し、メンバーとの間で認識齟齬がないかを確認します(図1④)。その上で、再度メディカルアドバイザリーボードを開催し、目的に対して十分に網羅的な、あるいは集約・合意された意見が得られるまで繰り返し実施します(図1③④)。最後に、収集した意見とそこから得られる示唆、目的に対する達成状況を整理し、報告書を作成します(図1⑤)。
メディカルアドバイザリーボード開催の課題と対策
最大の課題はフィードバックの際に最初の段階に戻る場合です。例えば、エビデンス創出やメディカル戦略の立案において、図1③④を繰り返している最中に新たなエビデンスが発表されるなど、前提としていた状況に変化が生じた場合、あるいはメディカルアドバイザリーボードの求めに応じて提出した情報が想定と異なっていた場合などに、収集済みの意見の意義が薄れてしまうリスクがあります。事前に状況の変化や、前提条件の根拠の弱さが想定されるかどうか、追加調査や分析によってリスクを軽減できるかどうか、検討が重要となります。
メディカルアドバイザリーボード開催の注意点
未承認薬や未承認の用法・用量に関する情報の提供については、「医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律」1医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律、e-Govポータル、1960年、https://elaws.e-gov.go.jp/document?lawid=335AC0000000145、2024年4月9日や日本製薬工業協会の「製薬協コード・オブ・プラクティス」2日本製薬工業協会、製薬協コード・オブ・プラクティス、日本製薬工業協会ホームページ、2019年、https://www.jpma.or.jp/basis/code/lofurc0000001dqt-att/code2.pdf、2024年4月9日において、販売促進に繋がりうるような積極的な情報提供が禁止されています。一方で、メディカルアドバイザリーボードにおいても、未承認薬や未承認の用法・用量に関して医科学専門家の意見を求める場合がありえます。もし、情報提供や販売促進が目的であると見なされた場合には、開催した企業だけでなくアドバイザリーボードメンバーの医科学専門家にとってもリスクとなるため3一般社団法人日本製薬医学会、メディカルアドバイザリーボードミーティングの実施に関する提言、一般財団法人日本製薬医学会ホームページ、2023年、https://japhmed.jp/files/Proposal_for_MABM_20230519.pdf、2024年4月9日、開催の体制・プロセス・運営においては第三者の視点から注意深く精査する必要があります。
- 1医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律、e-Govポータル、1960年、https://elaws.e-gov.go.jp/document?lawid=335AC0000000145、2024年4月9日
- 2日本製薬工業協会、製薬協コード・オブ・プラクティス、日本製薬工業協会ホームページ、2019年、https://www.jpma.or.jp/basis/code/lofurc0000001dqt-att/code2.pdf、2024年4月9日
- 3一般社団法人日本製薬医学会、メディカルアドバイザリーボードミーティングの実施に関する提言、一般財団法人日本製薬医学会ホームページ、2023年、https://japhmed.jp/files/Proposal_for_MABM_20230519.pdf、2024年4月9日
この記事はメール会員専用の記事です。
メール会員登録すると続きをお読みいただけます。




